Shtytja e çifteve elektronike dhe vendosja e atomeve nё molekula
1. Teoria e shtytjes sё çifteve elektronike tё shtresёs valentore (SHÇESHV).
Kjo teori bazohet nё shtytjen elektrostatike ndёrmjet çifteve elektronike tё vendosura rreth atomit qendror tё njё molekule ose joni. Çiftet elektronike tё shtresёs valentore, duke pasur ngarkesa me shenja tё njёjta, shtyhen reciprokisht. Si rezultat i kёsaj shtytjeje ato vendosen nё largёsitё mё tё mёdha tё mundshme nga njera-tjetra, nё mёnyrё qё forcat shtytёse elektrostatike tё jenё sa mё tё vogla.
2. Pёrcaktimi i formёs gjeometrike tё molekulave tё ndryshme
Pёr tё parashikuar formёn gjeometrike tё molekulave ёshtё e nevojshme tё numёrohen çiftet elektronike vetjake dhe çiftet elektronike lidhёse. Duhet tё dimё qё shtytja ёshtё maksimale ndёrmjet dy çifteve vetjake (ÇV), minimale ndёrmjet dy çifteve lidhёse (ÇL) dhe e ndёrmjetme ndёrmjet njё çifti lidhёs dhe njё çifti vetjak. Ne do tё shohim rastet kur atomi qendror formon 2-4 çifte elektronike tё pёrbashkёta dhe rastet kur numri i pёrgjithshёm i çifteve elektronike rreth atomit qendror (ÇL + ÇV) nuk ёshtё mё i madh se katёr.
Molekula e klorurit tё beriliumit BeCl2:
Atomi qendror ёshtё beriliumi. Ai ka dy elektrone nё shtresёn valentore. Nё molekulёn BeCl2 , secili nga kёto elektrone pёrdoret pёr tё formuar njё lidhje kovalente me njё elektron tё atomit tё klorit. Atomi i beriliumit Be rrethohet nga dy çifte lidhёse (ÇL) dhe asnjё çift vetjak (ÇV). Struktura e Ljuisit për molekulën e klorurit tё beriliumit BeCl2 ёshtё :
![]()
Çiftet lidhёse do tё vendosen nё anёt e kundёrta tё bёrthamёs sё atomit qёndror. Molekula ёshtё lineare. Kёndi i formuar nga tё dy lidhjet, kёndi i lidhjes ёshtё 180˚
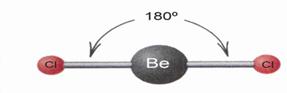
Forma gjeometrike e BeCl2 (lineare)
Molekula e klorurit tё borit BCl3
Atomi qendror ёshtё bori. Ai ka tri elektrone valentore. Bori formon tri lidhje kovalente me tri atomet e klorit sipas skemёs:
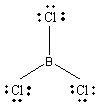
Nё kёtё molekulё atomi i borit ёshtё i rrethuar nga tri çifte lidhёse. Kёto çifte do tё orientohen sipas kulmeve tё trekёndёshit barabrinjёs. Pra, kemi njё vendosje trekёndore planare. Ky orientim siguron shtytjen minimale ndёrmjet çifteve lidhёse. Kёndi i formuar nga tё tri lidhjet, nё kёtё molekulё ёshtё 120˚
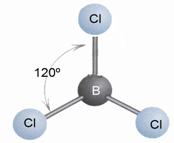
Forma gjeometrike e BCl3 (trekёndore planare)
Molekula e metanit CH4
Atomi qendror ёshtё karboni. Ai ka katёr elektrone valentore. Nё molekulёn e metanit atomi i karbonit formon katёr lidhje kovalente me katёr atomet e hidrogjenit sipas skemёs:

Nё kёtё molekulё atomi i karbonit ёshtё i rrethuar nga katёr çifte lidhёse. Kёto çifte do tё orientohen sipas kulmeve tё tetraedrit tё rregullt. Nё kёtё renditje, tё gjitha lidhjet janё tё baraslarguara nga njera- tjetra dhe tё gjitha kёndet e lidhjes janё 109,5˚
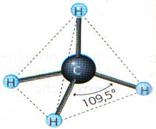
Forma gjeometrike e CH4 (tetraeder i rregullt)
Molekula e amoniakut NH3
Atomi qendror ёshtё azoti. Ai ka pesё elektrone valentore. Nё molekulёn NH3 tri nga elektronet e azotit, pёrdoren pёr tё formuar tri lidhje kovalente me tri atomet e hidrogjenit. Dy elektronet valentore tё azotit nuk marrin pjesё nё lidhje. Ato formojnё njё çift vetjak. Pra, atomi i azotit ёshtё i rrethuar nga katёr çifte elektronike: tri çifte lidhёse (ÇL) dhe njё çift vetjak (ÇV). Struktura e Ljuisit pёr NH3 ёshtё:
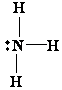
Tё katёr çiftet elektronike do tё orientohen sipas kulmeve tё tetraedrit. Nё kёtё rast, nё tri kulmet e tetraedrit janё vendosur atomet e hidrogjenit, kurse nё kulmin e katёrt, nё dallim nga molekula e metanit, orientohet çift vetjak . Reja elektronike e kёtij çifti ёshtё e tёrhequr nga azoti dhe shtyn mё fort çiftet lidhёse, duke bёrё qё kёndi i lidhjes tё mos jetё 109,5˚ si te tetraedri i rregullt. Ky kёnd ёshtё 107˚. Meqёnёse gjeometria e molekulave pёrcaktohet nga pozicioni qё zёnё bёrthamat e atomeve qё formojnё molekulёn, forma e kёsaj molekule ёshtё ajo e njё piramide me bazё trekёndore. Atomi i azotit ndodhet nё kulmin e piramidёs, kurse atomet e hidrogjenit nё kulmet e trekёndёshit tё bazёs.
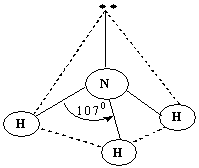
Forma gjeometrike e NH3 (piramidё me bazё trekёndore)
Molekula e ujit H2O
Atomi qendror ёshtё oksigjeni. Ai ka gjashtё elektrone valentore. Nё molekulёn H2O dy nga elektronet e oksigjenit, pёrdoren pёr tё formuar dy lidhje kovalente me dy atomet e hidrogjenit. Katёr elektronet valentore tё oksigjenit nuk marrin pjesё nё lidhje. Ato formojnё dy çifte vetjake. Pra, atomi i oksigjenit ёshtё i rrethuar nga katёr çifte elektronike: dy çifte lidhёse (ÇL) dhe dy çifte vetjake (ÇV). Struktura e Ljuisit pёr H2O ёshtё:
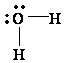
Tё katёr çiftet elektronike do tё orientohen sipas kulmeve tё tetraedrit. Nё kёtё rast, nё dy kulmet e tetraedrit janё vendosur atomet e hidrogjenit, kurse nё dy kulmet e tjera, orientohen dy çifte vetjake . Reja elektronike e kёtij çifti ёshtё e tёrhequr nga oksigjeni dhe shtyn mё fort çiftet lidhёse, duke bёrё qё kёndi i lidhjes tё mos jetё 109,5˚ si te tetraedri i rregullt. Ky kёnd ёshtё 104,5˚. Meqёnёse gjeometria e molekulave pёrcaktohet nga pozicioni qё zёnё bёrthamat e atomeve qё formojnё molekulёn, forma e kёsaj molekule ёshtё kёndore.
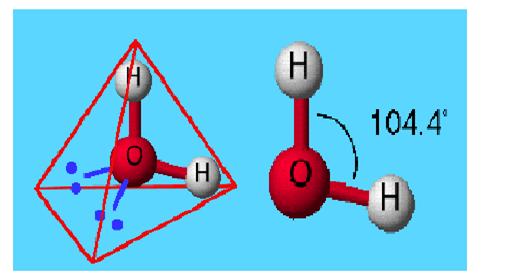
Forma gjeometrike e H2O (kёndore)
Këto dukuri ilustrohen me anë të appletit, i cili ekzekutohet pasi shkarkohet duke klikuar kёtu. Më poshtë jepet përshkrimi dhe përdorimi i tij
Pёrdorimi i apletit
Kliko: Model
Pёr tё ndёrtuar modelet e molekulave do tё bazoheni nё formёn gjeometrike tё tyre, e cila
pёrcaktohet nё bazё tё SHÇESHV-it. Shqyrtojmё rastet:
1. Atomi qendror formon dy çifte lidhёse
Kliko tek lidhje: lidhjen njёfishe dy herё, ndёrtohet modeli i molekulёs. Atomi qendror krijon dy çifte lidhёse qё janё tё pёrbashkёta me dy atomet e tjerё qё vendosen nё mёnyrё lineare rreth tij.
Kliko tek opsione: shfaq kёndin e lidhjes
- Kёndi i lidhjes ёshtё 180˚
Kliko tek emri: gjeometria e molekulёs
- Forma e molekulёs ёshtё lineare
Shembuj: BeF2, BeCl2, BeH2, etj
2. Atomi qendror formon tri çifte lidhёse
Kliko tek lidhje: lidhjen njёfishe tri herё, ndёrtohet modeli i molekulёs. Atomi qendror krijon tri çifte lidhёse qё janё tё pёrbashkёta me tri atomet e tjerё. Vendosja e atomeve kundrejt atomit qendror ёshtё sipas kulmeve tё trekёndёshit barabrinjёs.
Kliko tek opsione: shfaq kёndin e lidhjes
- Kёndi i lidhjes ёshtё 120˚
Kliko tek emri: gjeometria e molekulёs
- Forma e molekulёs ёshtё trigonale planare
Shembuj: BF3, BCl3, AlBr3, etj
3. Atomi qendror formon katёr çifte lidhёse
Kliko tek lidhje: lidhjen njёfishe katёr herё, ndёrtohet modeli i molekulёs. Atomi qendror krijon katёr çifte lidhёse qё janё tё pёrbashkёta me katёr atomet e tjerё. Vendosja e atomeve kundrejt atomit qendror ёshtё sipas kulmeve tё tetraedrit tё rregullt.
Kliko tek opsione: shfaq kёndin e lidhjes
- Kёndi i lidhjes ёshtё 109,5˚
Kliko tek emri: gjeometria e molekulёs
- Forma e molekulёs ёshtё tetraedri i rregullt.
Shembuj: CF4, SiCl4, CH4, CCl4, CBr4, SnCl4 etj
Ju mund tё ndёrtoni modele tё ndryshme molekulash.
Kliko: Molekula reale
Molekulat reale qё ju jepen janё: BeCl2, BF3, CH4, PCl5, SF6.
Si do tё veproni pёr tё parё modelet e molekulave?
Kliko tek molekula:
- P.sh molekula BF3
Kliko tek opsione: shfaq kёndin e lidhjes
- Kёndi i lidhjes ёshtё 120˚
Kliko tek emri: gjeometria e molekulёs
- Forma e molekulёs sё BF3 ёshtё trigonale planare
Nё tabelё shfaqet forma dhe kёndi i lidhjes.
Nё applet-in tjetёr i cili ekzekutohet pasi shkarkohet duke klikuar kёtu, krahas molekulave tё mёsipёrme, do tё shohim rastet ku atomi qendror krahas tri çifteve lidhёse ka dhe çifte vetjake.
Kliko: Model
Shqyrtojmё rastet ku:
1. Atomi qendror formon tri çifte lidhёse dhe njё çift vetjak
Kliko tek lidhje: lidhjen njёfishe tri herё.
Kliko tek çift vetjak: njё herё.
Ndёrtohet modeli i molekulёs. Atomi qendror krijon tri çifte lidhёse dhe njё çift vetjak. Vendosja e atomeve kundrejt atomit qendror ёshtё ajo e njё piramide me bazё trekёndore, ku atomi qendror ndodhet nё kulmin e piramidёs, kurse atomet tё cilёt lidhen me tё nё kulmet e trekёndёshit tё bazёs.
Kliko tek opsione: shfaq kёndin e lidhjes.
- Kёndi i lidhjes ёshtё 107˚
Kliko tek emri: gjeometria e molekulёs.
- Forma e molekulёs ёshtё piramidё me bazё trekёndore
- Shembuj: NH3, PH3, PCl3, etj
Kliko tek emri: gjeometria e elektroneve.
- Tetraeder
Tё katёr çiftet elektronike do tё orientohen sipas kulmeve tё tetraedrit. nё tri kulmet e tetraedrit janё vendosur atomet qё lidhen me atomin qendror , kurse nё kulmin e katёrt orientohet çifti vetjak . Reja elektronike e çiftit vetjak, shtyn fort çiftet lidhёse, duke bёrё qё kёndi i lidhjes tё mos jetё 109,5˚ si te tetraedri i rregullt. Ky kёnd ёshtё 107˚.
2. Atomi qendror formon dy çifte lidhёse dhe dy çifte vetjake
Kliko tek lidhje: lidhjen njёfishe dy herё
Kliko tek çift vetjak: dy herё
Ndёrtohet modeli i molekulёs. Atomi qendror krijon dy çifte lidhёse dhe dy çifte vetjake. Forma e kёsaj molekule ёshtё kёndore.
Kliko tek opsione: shfaq kёndin e lidhjes
- Kёndi i lidhjes ёshtё 104,5˚
Kliko tek emri: gjeometria e molekulёs
- Forma e molekulёs ёshtё kёndore
- Shembuj: H2O, H2S, OF2, etj
Kliko tek emri: gjeometria e elektroneve
- Tetraeder
Tё katёr çiftet elektronike do tё orientohen sipas kulmeve tё tetraedrit. Nё dy kulmet e tetraedrit janё vendosur atomet qё lidhen me atomin qendror, kurse nё dy kulmet e tjera orientohen dy çiftet vetjake.. Reja elektronike e çiftit vetjak, shtyn fort çiftet lidhёse, duke bёrё qё kёndi i lidhjes tё mos jetё 109,5˚ si te tetraedri i rregullt. Ky kёnd ёshtё 104,5˚.
Ju mund tё ndёrtoni modele tё ndryshme molekulash.
Kliko: Molekula reale
Molekulat reale qё ju jepen janё: H2O, NH3, CH4, PCl5, SF6., BF3, CO2, SO2, etj
Si do tё veproni pёr tё parё modelet e molekulave?
Kliko nё tabelё: reale
Kliko tek molekula:
- P.sh molekula H2O
Kliko tek opsione: shfaq kёndin e lidhjes.
- Kёndi i lidhjes ёshtё 104,5˚
Kliko tek opsione: shfaq çift vetjak
- Atomi qendror krijon dy çifte lidhёse dhe dy çifte vetjake.
Kliko tek emri: gjeometria e molekulёs
Forma e molekulёs sё H2O ёshtё kёndore
Kliko tek emri: gjeometria e elektroneve
- Tetraeder
Nё tabelё shfaqet forma dhe kёndi i lidhjes.